Nadczynność kory nadnerczy u psów
-
Dr n. wet. Olga Gójska-Zygner
-
Nadczynność kory nadnerczy u psów
Nadczynność kory nadnerczy u psów (choroba nazywana również zespołem Cushinga) jest jedną z najczęstszych chorób psów o podłożu endokrynologicznym wynikającą ze zwiększenia stężenia glikokortykosteroidów we krwi na skutek nadprodukcji kortyzolu (główne hormon glikokortykosteroidowy u psów) lub stosowania ich w celach terapeutycznych (Herrtage 2004). W większości przypadków (około 80 % psów z zespołem Cushinga) choroba spowodowana jest przez aktywny hormonalnie guz przysadki (gruczolak przysadki) produkujący hormon adrenokortykotropowy (ACTH). W tych przypadkach nadprodukcja ACTH trwale stymuluje nadnercza do nadmiernej produkcji kortyzolu (Behrend i Melian 2013; Galac i wsp. 2010). Ta postać choroby nazywana jest przysadkowo-zależną nadczynnością kory nadnerczy (Herrtage 2004). W większości pozostałych przypadków (15 – 20 % psów z nadczynnością kory nadnerczy) choroba spowodowana jest przez aktywny hormonalnie guz nadnercza (łagodny lub złośliwy) produkujący kortyzol w nadmiarze niezależnie od stymulacji przez przysadkę (Behrend i Melian 2013; Galac i wsp. 2010). Ta forma hiperadrenokortycyzmu nazywana jest nadnerczowo-zależnym zespołem Cushinga (Herrtage 2004). Do pozostałych form hiperadrenokortycyzmu należą jatrogenny zespół Cushinga oraz niezmiernie rzadkie przypadki hiperadrenokortycyzmu związane ze: zwiększonym stężeniem steroidowych hormonów płciowych, zespołem ektopowego wydzielania ACTH (sekrecyjnie aktywne guzy w innych narządach produkujące w nadmiernej ilości ACTH) oraz żywieniowo-zależną (poposiłkową) hiperkortzyolemią (Galac i wsp.. 2008; Galac i wsp. 2010; Greco 2007; Herrtage 2004; Syme i wsp. 2001). Nadczynność kory nadnerczy występuje głównie u psów w średnim wieku i starszych. Wyższe ryzyko zachorowań występuje u ras psów takich jak: pudel, jamnik, różne rasy mniejszych terierów (m.in. Yorkshire Terrier, Jack Russell Terrier czy Staffordshire Bull Terrier), beagle, bokser, owczarek niemiecki (Behrend i Melian 2013; Galac i wsp. 2010; Herrtage 2004).
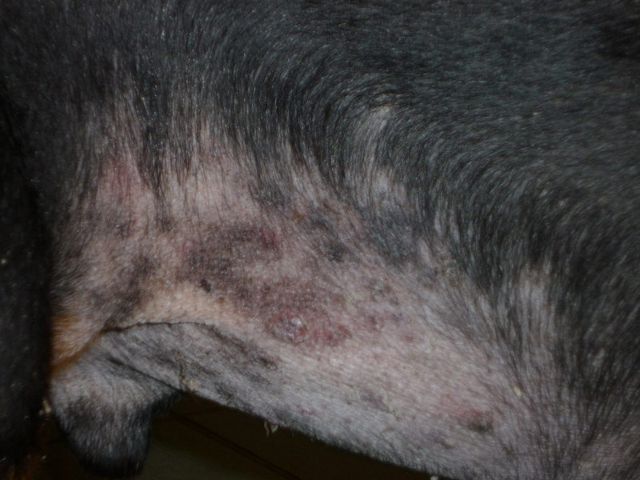
Częstymi objawami zespołu Cushinga są: poliuria (nadprodukcja moczu), polidypsja (zwiększone pragnienie), polifagia (wzmożony apetyt), przybieranie na wadze, wyłysienia (często symetryczne), powiększony obrys brzucha (spowodowany gromadzeniem się tłuszczu w jamie otrzewnej oraz powiększeniem wątroby) z uwidocznieniem powierzchownych naczyń krwionośnych, słabość mięśniowa (powodująca zmniejszenie aktywności fizycznej, nietolerancję wysiłkową, niezdolność do wchodzenia po schodach czy też wskakiwania do samochodu) i ścieńczenie skóry (spowodowane zanikami mięśniowymi i skórnymi), hiperpigmentacja (pociemnienie skóry), oraz atrofia jąder u samców bądź wydłużenie fazy anestrus u niekastrowanych suk (Behrend i Melian 2013; Galac i wsp. 2010; Herrtage 2004). Powikłaniami nadczynności kory nadnerczy u psów mogą być cukrzyca (insulino-oporna), zakażenia dróg moczowych oraz nadciśnienie, tromboembolizm płucny (niedrożność płucnych naczyń krwionośnych spowodowany skrzeplinami) (Behrend i Melian 2013; Galac i wsp. 2010; Johnson 2009).
Rozpoznanie hiperadrenokortycyzmu prócz danych z wywiadu i badania klinicznego wymaga również wykazania zwiększonej syntezy kortyzolu i zaburzenia działania osi podwzgórzowo-przysadkowo-nadnerczowej (Galac i wsp. 2010). W rozpoznaniu lub wykluczeniu zespołu Cushinga zastosowanie znajdują testy (również testy czynnościowe) takie jak: testy hamowania deksametazonem, test stymulacji ACTH, oznaczanie stosunku stężenia kortyzolu do kreatyniny w moczu, oznaczanie stężenia ACTH w osoczu krwi. Testy te pomocne są również w różnicowaniu różnych postaci zespołu Cushinga u psów oraz monitorowaniu efektów terapeutycznych (Galac i wsp. 2010; Rijnberk i Kooistra 2010). Należy jednak podkreślić, że inne współwystępujące choroby, stres oraz niektóre leki (np. glikokortykosteroidy) wpływają na wyniki oznaczania kortyzolu (zmienione stężenie) i każdy z tych testów może dawać wyniki zarówno fałszywie dodatnie jak i fałszywie ujemne (Herrtage 2004; Rijnberk i Kooistra 2010). Ponadto, warto również dodać, że w diagnostyce, różnicowaniu postaci oraz wyborze sposobu leczenia hiperadrenokortycyzmu u psów użyteczne są różne techniki obrazowania takie jak ultrasonografia, tomografia komputerowa czy rezonans magnetyczny (Behrend i Melian 2013; Galac i wsp. 2010).
W leczeniu zespołu Cushinga u psów w zależności od postaci choroby oraz stopnia jej zaawansowania (tj. przysadkowo-zależny lub nadnerczowo-zależny zespół Cushinga; guz nadnercza występujący jednostronnie lub obustronnie; z przerzutami do płuc bądź bez przerzutów płucnych) stosowane może być leczenie farmakologiczne lub chirurgiczne (usunięcie nadnercza lub przysadki) (Herrtage 2004; Behrend i Melian 2013; Galac i wsp. 2010). Z kolei leczenie jatrogennej postaci choroby Cushinga spowodowanej leczeniem przy użyciu glikokortykosteroidów wymaga stopniowej obniżania dawki leku. Zbyt szybkie zmniejszenie dawki lub nagłe całkowite odstawienie glikokortykosteroidów prowadzi w tym przypadku do rozwoju jatrogennej postaci hipoadrenokortycyzmu (niedoczynności kory nadnerczy), który jest skutkiem indukowanej glikokortykosteroidami supresji osi podwzgórzowo-przysadkowo-nadnerczowej. Supresja ta powoduje atrofię warstwy pasmowatej i siatkowatej kory nadnerczy, i po długotrwałej terapii glikokortykosteroidami prawidłowe funkcjonowanie osi podwzgórzowo-przysadkowo-nadnerczowej może wrócić dopiero po upływie kilku miesięcy (Behrend i Melian 2013; Galac i wsp. 2010). Należy tutaj podkreślić, że również leczenie nadczynności kory nadnerczy (zarówno farmakologiczne jak i chirurgiczne) może doprowadzić do rozwoju jatrogennej postaci hipoadrenokortycyzmu (Behrend i Melian 2013; Galac i wsp. 2010; Gójska-Zygner i wsp. 2011).
Piśmiennictwo:Behrend E.N., Melian C. Hyperadrenocorticism in Dogs. In: Rand J., Behrend E.N., Gunn-Moore D. and Campbell-Ward M.L. (eds.) Clinical Endocrinology of Companion Animals. Wiley-Blackwell, Ames, 2013, pp. 43-64.
Galac S., Kars V.J., Voorhout G., Mol J.A., Kooistra H.S. ACTH-independent hyperadrenocorticism due to food-dependent hypercortisolemia in a dog: A case report. Veterinary Journal, 2008, 177, 141-143.
Galac S., Reusch C.E., Kooistra H.S., Rijnberk A. Adrenals. In: Rijnberk A. and Kooistra H.S. (eds.) Clinical Endocrinology of Dogs and Cats. An Illustrated Text. 2 nd ed. Schlütersche Verlagsgesellschaft, Hannover, 2010, pp. 93-154.
Gójska-Zygner O., Lechowski R., Zygner W. Canine iatrogenic persistent hypoadrenocorticism after short-term treatment of hyperadrenocorticism with trilostane – a case report. Veterinarski Arhiv, 2011, 81, 699-705.
Greco D.S. Hyperadrenocorticism Associated with Sex Steroid Excess. Clinical Techniques in Small Animal Practice, 2007, 22, 12-17.
Herrtage M.E. Canine hyperadrenocorticism. In: Mooney C.T. and Peterson M.E. (eds.) BSAVA Manual of Canine and Feline Endocrinology. 3 rd ed. British Small Animal Veterinary Association, Gloucester, 2004, pp. 150-171.
Johnson L.R. Pulmonary Thromboembolism. In: Silverstein D.C. and Hopper K. (eds.) Small Animal Critical Care Medicine. 1 st ed. Saunders Elsevier, St. Louis, 2009, pp. 114-117.
Rijnberk A., Kooistra H.S. Protocols for Function Tests. In: Rijnberk A. and Kooistra H.S. (eds.) Clinical Endocrinology of Dogs and Cats. An Illustrated Text. 2 nd ed. Schlütersche Verlagsgesellschaft, Hannover, 2010, pp. 305-314.
Syme H.M., Scott-Moncrieff J.C., Treadwell N.G., Thompson M.F., Snyder P.W., White M.R., Oliver J.W. Hyperadrenocorticism associated with excessive sex hormone production by an adrenocortical tumor in two dogs. Journal of the American Veterinary Medical Association, 2001, 219, 1725-1728.
 Strona używa plików cookies do celów funkcjonalnych oraz statystycznych
Strona używa plików cookies do celów funkcjonalnych oraz statystycznych